La variación de la conductividad equivalente
de un electrolito fue caracterizada experimentalmente
por Kohlrausch, a una temperatura determinada, frente a la raíz cuadrada de
la concentración, y, para algunos electrolitos, las gráficas obtenidas en el dominio
de bajas concentraciones correspondían con bastante precisión a una línea
recta.
Éstas gráficas, para varios
electrolitos se representan en la figura 1. Aquí se observa que aparecen dos
tipos diferentes de comportamiento: aquellos electrolitos que presentan esencialmente
variación lineal, se les agrupa entre los electrolitos fuertes; mientras que,
los que se aproximan a la conductividad límite de forma casi tangencial, están
agrupados como electrolitos débiles.
De la figura 1 se puede observar una
interesante relación al extrapolar los valores de las conductividades de los
electrolitos hasta la dilución infinita, para obtener la llamada conductividad
equivalente límite. Éstas conductividades, que se representan por Λo, son la
base de la Ley de Kohlrausch o de la migración independiente de los iones.
FIGURA 1. Variación de la Conductividad equivalente en función de 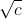 para algunas disoluciones
acuosas de electrolitos, a 25°C
para algunas disoluciones
acuosas de electrolitos, a 25°C
La conductividad del electrolito
a dilución infinita se considera como resultado de las contribuciones de las
dos clases de iones individuales que forman al electrolito. De esta forma, se
introducen los conceptos de conductividades iónicas equivalentes, que para dilución infinita permiten establecer que:
Λo = λo+ + λo- (Idealidad)
La ley de Kohlrausch sugiere
ahora, que la conductividad a dilución infinita de un electrolito depende de
las contribuciones independientes de los iones que lo conforman. La independencia
de éstas contribuciones se pone de manifiesto al comparar electrolitos que tienen
algún ión común; pero la ley de Kohlrausch no suministra, y así debe
destacarse, la forma de calcular las contribuciones individuales de los
diferentes iones, solo permite evaluar variaciones (∆).
La aplicación práctica e
inmediata de la idea de una contribución independiente de los iones a dilución
infinita, es el camino para deducir el valor de la conductividad límite de los
electrolitos débiles. Por ejemplo, para el ácido acético se puede establecer
que:
Λo (HAc) = Λo (Na Ac) + Λo (HCl)
- Λo (NaCl)
porque el miembro derecho de la
ecuación cabe interpretarlo como:
λoNa+ + λoAc- +
λoH+ + λoCl- - λoNa+ - λoCl- = λoH+
+ λoAc- = Λo (HAc)
Universidad de Antioquia (Colombia). Facultad de Ciencias Exactas y Naturales. Química Analítica II.




